-
【实验技术笔记】细胞表型检测之细胞粘附(细胞粘附实验) + 细胞侵袭(transwell实验)
1. 细胞粘附 Cell Adhesion
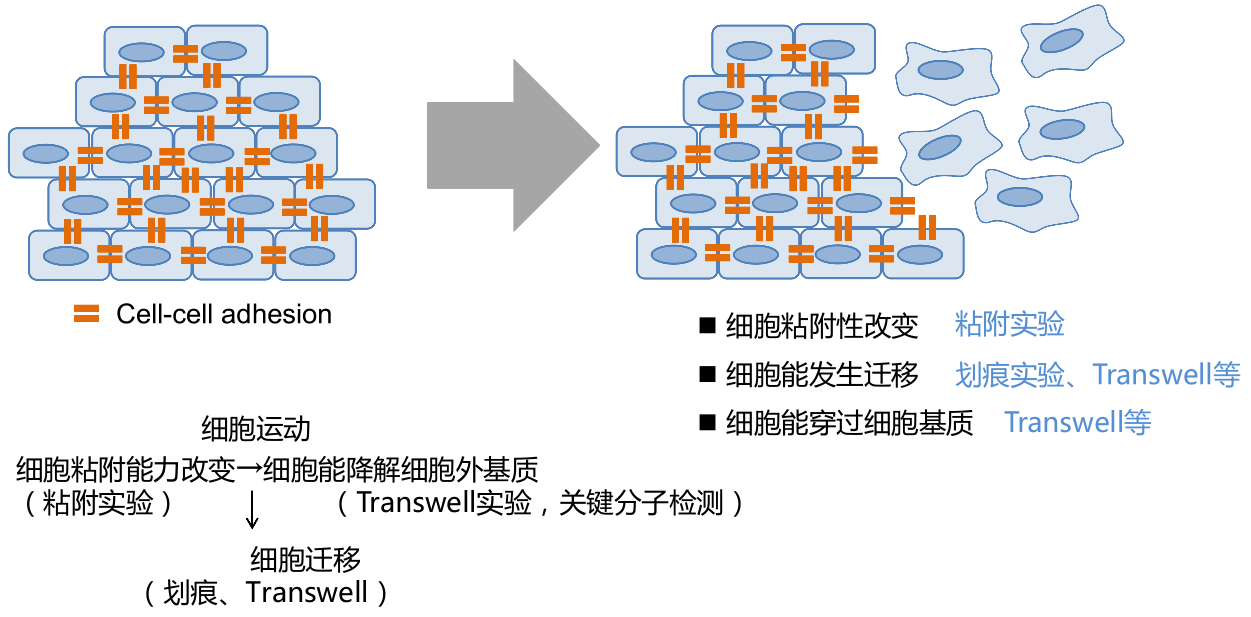
- 体内细胞想要运动,就要先脱离其他细胞,细胞粘附能力发生改变(
细胞粘附实验); - 体内细胞还被细胞外基质包裹,要穿过细胞外基质,就要能降解细胞外基质组分,细胞侵袭能力发生改变(用 matrigel 的 transwell 实验来观察细胞的侵袭能力);
- 细胞要移动,其自身还需要发生变形,细胞极性发生改变,具有迁移能力(划痕、Transwell)。
细胞粘附 Cell Adhesion
- 细胞粘附
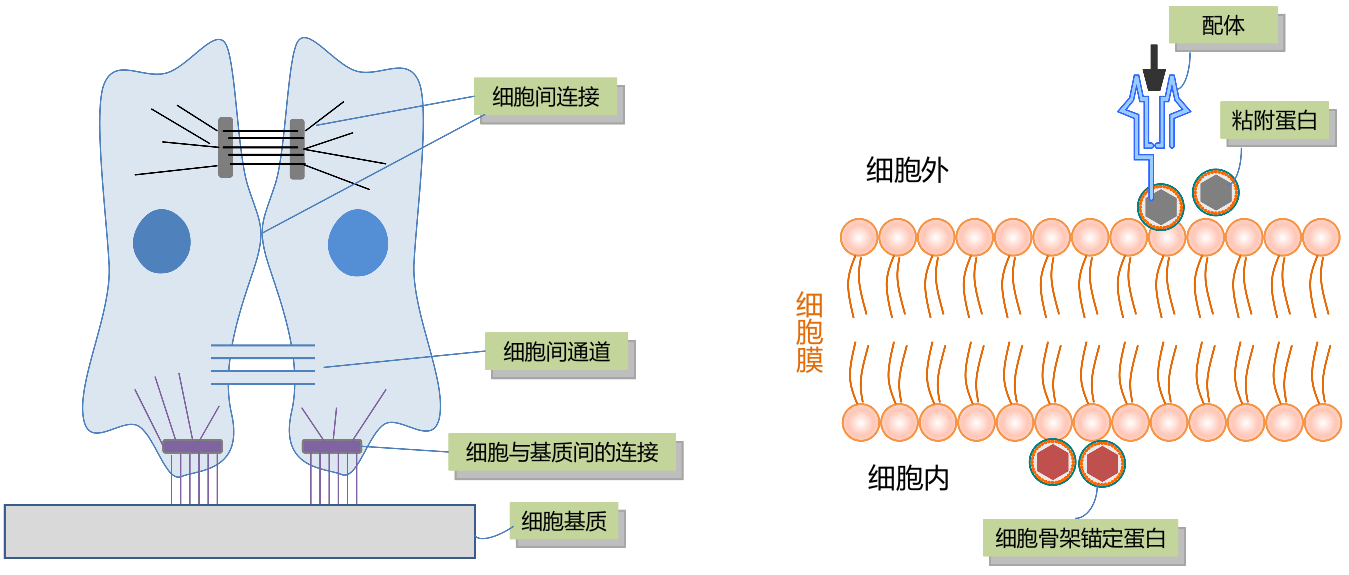
Cell Adhesion:细胞通过直接或间接作用,与相邻细胞发生接触和相互作用。可以是通过细胞表面接触(各种细胞连接或细胞间通道)发生直接作用,也可以是通过细胞外基质产生间接作用。
2. 检测细胞粘附:细胞粘附实验
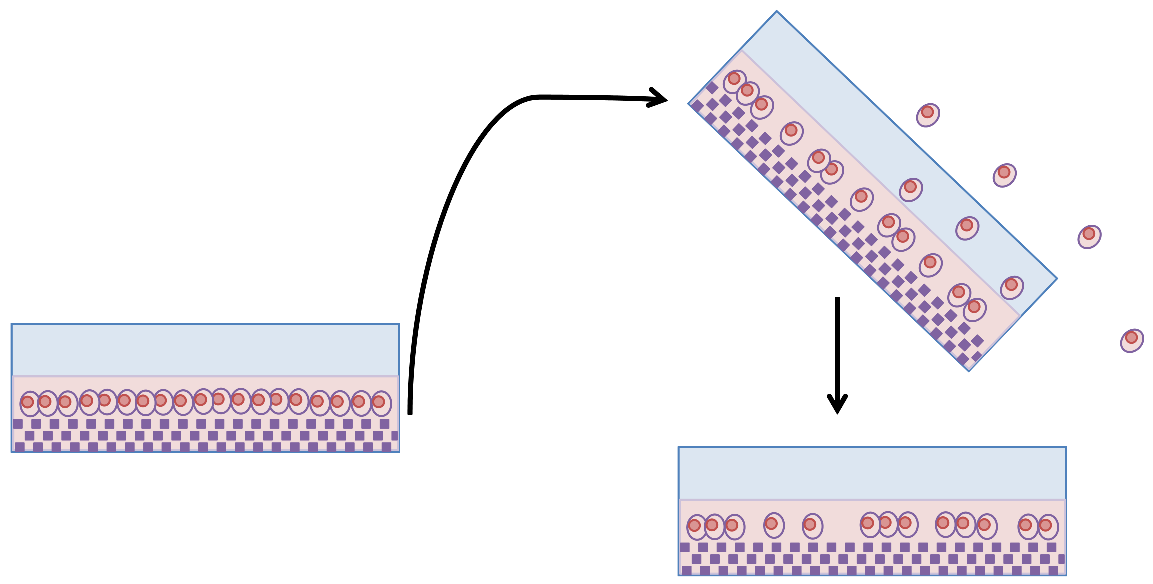
细胞粘附实验(cell-adhesion assay)检测细胞粘附的原理
-
终点检测类实验:检测细胞在一个模拟基质的表面粘附的细胞数是变多还是变少了。
-
使用细胞外基质的组分(模拟细胞外基质)包被 96 孔板,接种细胞培养后,用 PBS 洗,粘附能力强的细胞就不容易洗掉,粘附能力弱的就容易被洗掉,然后用 CCK-8 孵育显色,酶标仪检测显色程度从而反应粘附的细胞数。
-
模拟细胞在体内的粘附。
细胞粘附实验的操作流程
- 适用于检测贴壁的细胞,不适用于检测组织样本(组织样本可以检测与细胞粘附相关分子的表达) 。
- 包被培养板:10μg/ml
fibronectin纤连蛋白 或collagen胶原 室温包被 96 孔板 1h。(不同的包被组分可能导致不同的实验结果,需要预实验确认包被组分和浓度) - BSA 浸洗 :吸去包被液,加入 200μl 热变性的 1%BSA(BSA 配好后高温高压) 在 37℃孵育孔板 1h。
- 培养基浸洗 :使用不含血清的培养基浸洗孔板 2 次。
- 制备细胞悬液:含 EDTA 的胰酶消化细胞,用含血清的培养基终止消化,再用无血清培养基洗涤细胞并重悬。
- 种板 :细胞计数后将 3-5×104 个细胞铺在预处理好的 96 孔板中。
- 继续培养 :细胞培养箱中培养,时间视不同细胞而定。(预实验确认,短的 1h,长的 8-9h,或者过夜,依据细胞粘附能力而定,强的时间缩短,弱的延长)
- 洗去未粘附细胞 :PBS 洗 3 次。留一组不洗,测总细胞数。
- CCK8 检测 :使用 CCK8 法检测 96 孔板中的细胞数量。
参考:【实验技术笔记】细胞表型检测之细胞增殖(CCK-8 法 + BrdU 掺入法 + 平板克隆)
细胞粘附实验的分组设计
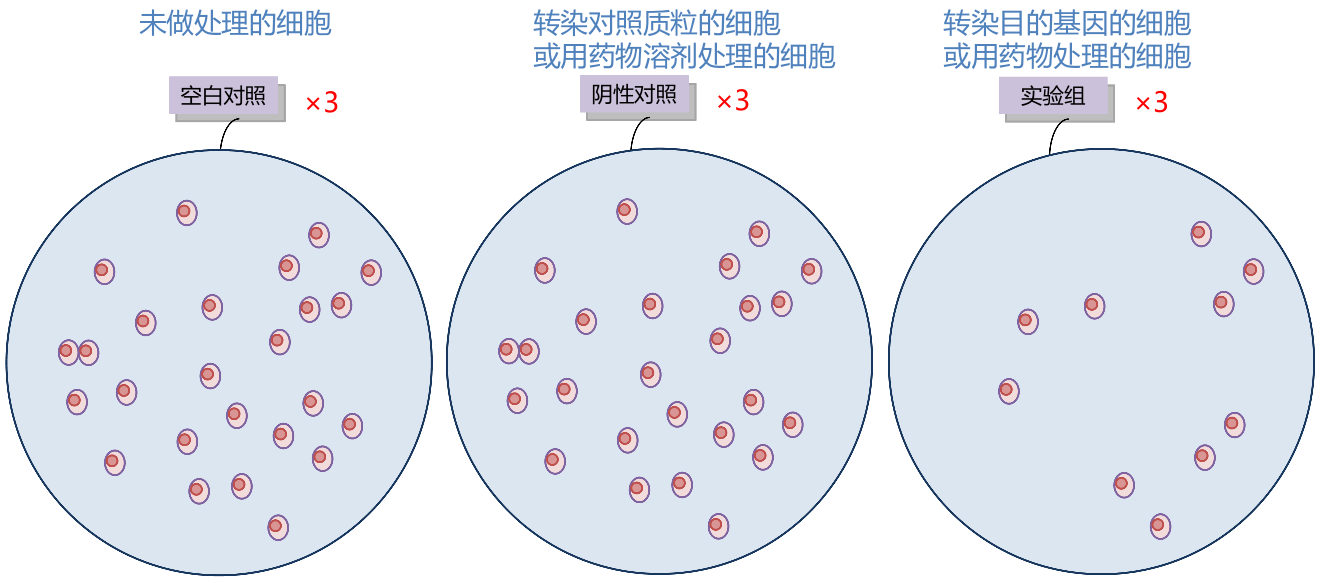
- 每个处理组的细胞除了按实验流程铺板后 PBS 洗过的孔(Adhesion cells),还要有铺板后未经过 PBS 洗的孔(Total cells)。
数据处理与绘图
-
细胞黏附率:cell adhesion (%) = 粘 附 细 胞 O D 值 总 细 胞 O D 值 \cfrac {粘附细胞 OD 值} {总细胞 OD 值} 总细胞OD值粘附细胞OD值 ×100%
-
将 3 次独立重复(3 次独立的实验,不是 3 个复孔)的数据都分析完后进行统计分析并绘制柱状图。
-
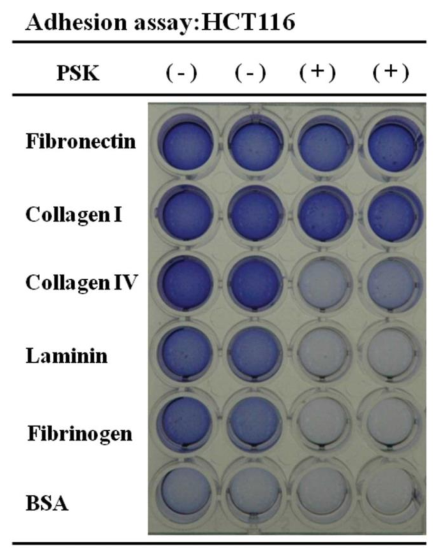
用不同组分包被 96 孔板得出的结果是不同的:
3. 细胞侵袭 Cell Invation
- 细胞侵袭
Cell Invation是指细胞通过细胞外基质从一个区域迁移到另一个区域的能力。 - 细胞侵袭是正常细胞和癌细胞应对化学和机械刺激的反应。在迁移到新区域之前,细胞外基质被细胞内的蛋白酶降解。细胞侵袭常发生于伤口修复、血管形成和炎症反应以及组织的异常浸润、肿瘤细胞转移等过程中。
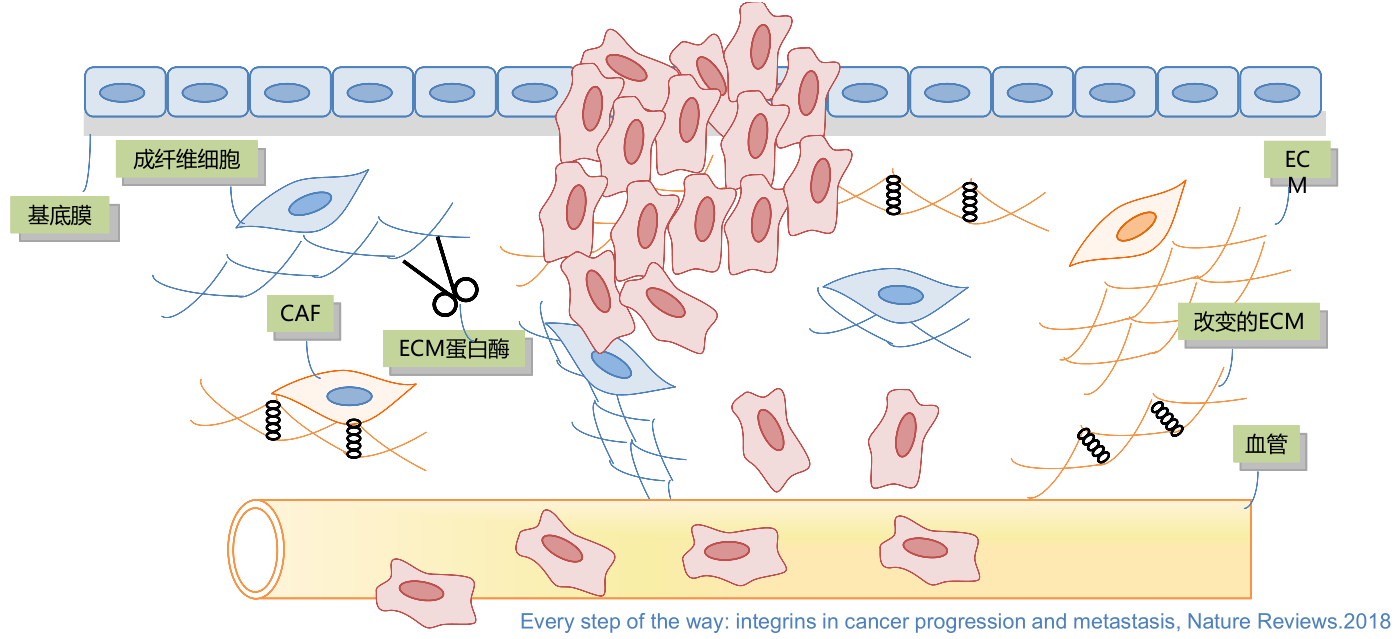
- 以肿瘤细胞侵袭为例:
在上皮细胞下方附着有一层基底膜,由基质 ECM 和网状纤维组成,含有丰富的糖蛋白、糖胺多糖和蛋白质。
当某些细胞发生癌变时,促肿瘤发生的整合素表达上调,一些信号通路活化(如 FAK、PI3K/AKT、MAPK 等),一些癌基因表达也发生改变,在基质中出现一些肿瘤相关的成纤维细胞CAF,ECM 分泌增多且发生交联形成异常的 ECM,肿瘤细胞发生迁移,ECM 蛋白酶发生活化,促使 ECM 更利于细胞侵袭,肿瘤细胞还能进一步侵入血管,形成随血道转移的微小克隆。
- 实验检测细胞侵袭过程:用 Matrigel 模拟体内的细胞外基质,用铺 Matrigel 的 transwell 实验来观察细胞的侵袭能力。
Matrigel:BD 专利的 Matrigel,是从富含胞外基质蛋白的 EHS 小鼠肿瘤中分离出来的,主要成分有层粘连蛋白、Ⅳ型胶原、巢蛋白、硫酸肝素糖蛋白,还包含一些生长因子、基质金属蛋白酶等。BD 的 Matrigel 在室温条件下能聚合成具有生物学活性的三维基质,可以用来模拟体内细胞基底膜的结构、组成、物理特性和功能。
参考:Matrigel (裸鼠接瘤用的基质胶)使用常见问题
4. 检测细胞侵袭:transwell 实验
- 与细胞迁移的 transwell 实验大致相同,只是要铺 Matrigel 胶。
transwell 实验(transwell assay)检测细胞侵袭的原理
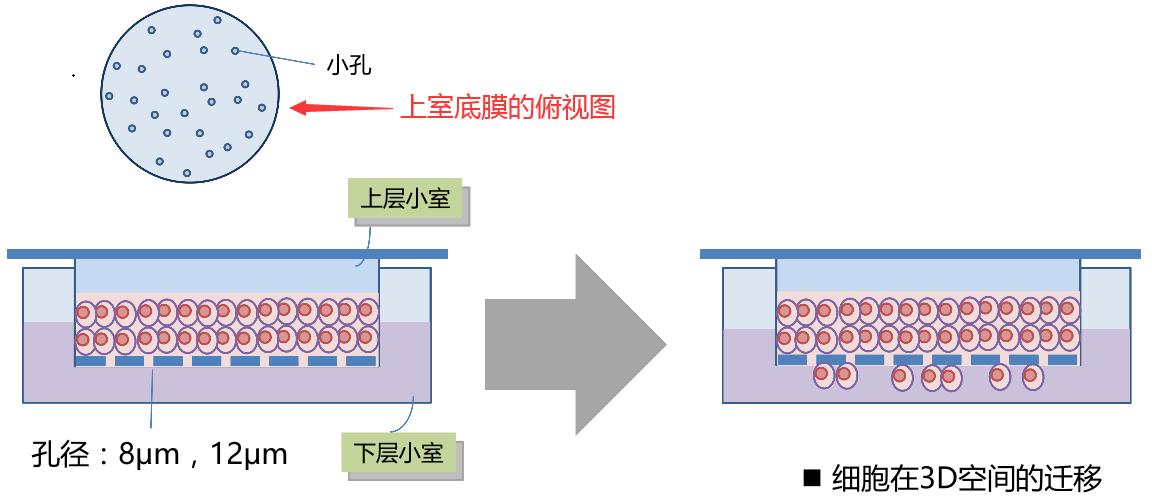
- 需要特定孔径的 transwell 板(transwell 小室)。
- 上室可以架在细胞培养板的孔上,底部是一层带很多小孔的薄膜(肉眼看不到孔,孔径大小根据培养的细胞大小来选择,一般下室 24 孔板的用孔径 8μm 的,肿瘤细胞侵袭实验常用 8µm、12µm 膜),不接触细胞培养板。
- 上室:用无血清或低血清(2-5%)培养基把
Matrigel胶按一定比例稀释,铺在上层小室中,然后接种细胞。 - 下室铺高血清培养基,培养基液面与上室底面相接,以诱导细胞侵袭。
- 在上室低血清培养基中种过量的细胞,如果细胞没有侵袭能力,8μm 的孔径小于细胞,上室中的细胞和培养液不能通过小孔进入下室;有侵袭能力的细胞能变形,下室铺的培养基多加血清,促使细胞侵袭到下室,细胞就会穿过小孔粘附在上室底膜的下表面(对于粘附能力弱的细胞,容易掉进下室,就需要在种细胞前预先对上室膜的下表面涂一些增加细胞粘附的东西,如 10ug/ml 的纤连蛋白)。
- 结束实验检测结果时,transwell 小室的上室膜上表面里会有大量没有穿过孔的细胞累积,上室膜的下表面粘附着穿过小孔的细胞,用棉签擦掉上室膜上表面的细胞,将上室放入染色液染色,使下表面的细胞着色,就可以在显微镜下拍照。
- 模拟细胞在 3D 空间的侵袭。
- transwell 板:
Corning 3422性价比较高。
transwell 实验检测细胞迁移的操作流程
- 适用于检测贴壁的细胞,不适用于检测组织样本 。
- 撤血清:换无血清或低血清(5% FBS,无血清不耐受时)培养基培养细胞,清除血清的影响。
- 铺基质胶:将
Matrigel基质胶适当稀释,铺在上层小室中,置细胞培养箱中聚合过夜。(与细胞迁移 transwell 实验不同的步骤)
◆Matrigel:一般含酚红,与碳酸氢盐、CO2相互作用会产生色差变化,可能变成淡黄色、粉红色、深红色,但在培养箱中放一段时间平衡之后,能抵消色差变化,变成粉红色。-20℃是固态的,冰浴时是液态的,22-25℃室温下形成凝胶状态。-20℃取出后,要在 4℃或冰上过夜冻融为液态,所有接触Matrigel的用品使用前都要冰浴预冷,整个操作流程都在冰上进行。
◆ 为了保证Matrigel的稳定性和成胶性能,稀释比例不低于 1:3(实际上,1:3 可能也很难做出来,根据不同细胞,做预实验确定稀释比例)
参考:Matrigel (裸鼠接瘤用的基质胶)使用常见问题
◆ 铺基质胶的方法:薄胶法、厚胶法。
薄胶法:-20℃取出后,在 4℃过夜为液态,用预冷的移液枪头混匀 Matrigel 胶,或者要稀释就用无血清培养基按比例稀释吹匀,枪头、培养板放冰上,往培养板 transwell 小室里放入浓度为 50ul/cm2的 Matrigel ,37℃放置 30min 或聚合过夜,聚合好的 Matrigel 看起来还是有点水水的,而不是硬的固体状。一般 Corning 3422 上层小室加 80-100ul 胶。(一般用薄胶法做侵袭实验)
厚胶法:-20℃取出后,在 4℃过夜为液态,用预冷的移液枪头混匀 Matrigel 胶,或者要稀释就用无血清培养基按比例稀释吹匀,枪头、培养板放冰上,将培养细胞与 Matrigel 混合后,加入培养板 transwell 小室,37℃放置 30min 成胶。 - 铺下室培养基:下室铺含 20% FBS 的培养基(有些特殊实验可以加趋化因子)。
- 制备细胞悬液:胰酶消化细胞,制备细胞悬液。
- 铺细胞:将上层小室放入下层小室,细胞计数后将细胞铺在上层小室中(一般铺 100ul 细胞,细胞要多一点)。
- 继续培养:细胞培养箱中培养 24-48 小时,具体时间视不同细胞而定(提前摸索时间,看细胞什么时候能穿过小孔。接种的细胞量和实验时间非常重要,如果细胞数太多或是培养时间太长,都会使本来有迁移及侵袭能力差别的细胞之间的差别不显著甚至是没有。这个首先可以参考文献的细胞用量及时间,再结合自己的要求进行实验,所以刚开始时不要做太多的处理组,而要把条件摸好再说)。
- 擦去上层细胞:用棉签(棉签头扯松一点,可以擦到边角)擦去上层小室里的细胞。
- 固定细胞:甲醇室温固定细胞 5min 或用 4%多聚甲醛室温固定 20min(防止细胞形态发生改变) 。
- 吉姆萨染色:吉姆萨染色液染细胞,去离子水适度漂洗,去除浮色。(吉姆萨染色液染的色很容易被水洗掉,染色后稍微漂洗 1-2s 就立刻观察细胞颜色)
- 拍照:把染色漂洗后的上室放在一片干净的载玻片上,带膜的底面贴着载玻片,拍照时不要让细胞完全干燥,可以微微湿润,借助水的折射可以让细胞拍出来更好看。拍照时,建议把上室底面按十字划分,沿十字线拍一遍,再把四角各拍一张,相当于把整个上室底面扫了一遍。
transwell 实验检测细胞迁移实验分组设计
数据处理与绘图
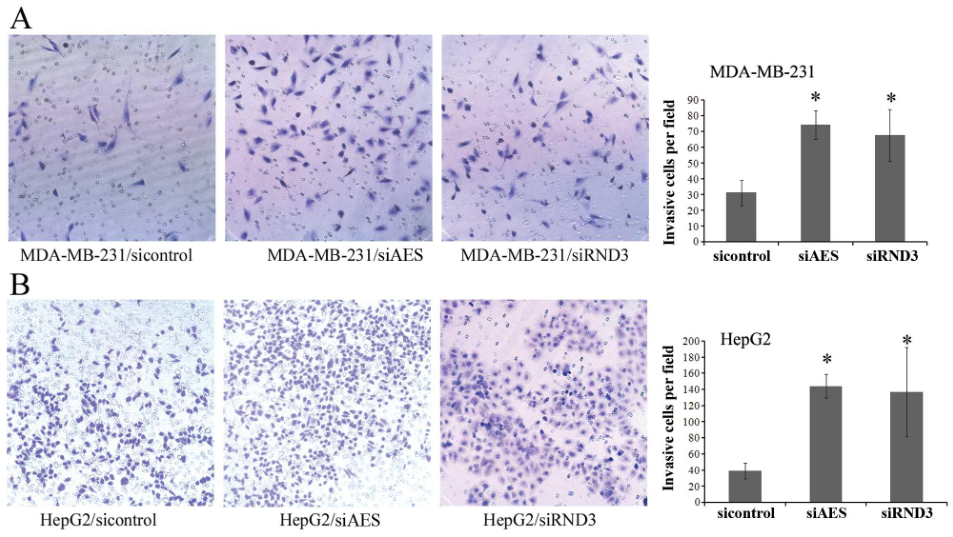
- 使用软件分析侵袭的细胞数(可以使用 image pro plus 或 imageJ)。
参考:应用 Image J 进行 Transwell 迁移细胞计数 - 将 3 次独立重复的数据都分析完后进行统计分析并绘制柱状图。
- 显微镜下拍到的图片,浅灰色底,紫红色细胞,任意拍几个视野,对图上细胞计数,按平均每个视野的细胞数做统计分析画图。
- 体内细胞想要运动,就要先脱离其他细胞,细胞粘附能力发生改变(
-
相关阅读:
SecureCRT隧道,跳板机+端口转发,内网穿透
加速推进企业信息化建设,SRM采购系统赋能建筑工程产业生态链实现数字化转型
c primer plus(2)
url取值的两种方式
Nginx + keepalived 实现高可用 + 防盗链 + 动静分离
JAVA小知识20:万字详解List与ArrayList
NTT的Another Me技术助力创造歌舞伎演员中村狮童的数字孪生体,将在 “Cho Kabuki 2022 Powered by NTT”舞台剧中首次亮相
使用 Promise.withResolvers() 来简化你将函数 Promise 化的实现~~
Turtlebot4入门教程-相关资源
Debian | 更换 Gnome 至 Xfce4
- 原文地址:https://blog.csdn.net/zea408497299/article/details/125459166