-
新版TCGA的突变SNP数据添加临床信息
今天给大家演示下如何用自己的数据完成
maftools的分析,主要是snp文件和临床信息的制作,其实很简单,但是网络上的教程都说的不清楚。这次我们直接用之前TCGA-COAD和TCGA-READ合并后的数据演示,合并教程请看前一篇推文(公众号翻历史推文)
加载数据和R包
因为现在的TCGA数据库不能直接下载4种制作好的maf文件了,需要自己整理,如果你还不知道怎么整理,请看这篇内容(去翻推文)
load(file = "./TCGA-colrectum/colrectal_snp.rdata") library(maftools)- 1
- 2
- 3
除此之外,我们还要给这个数据添加临床信息,也是只要先加载之前合并后的数据。
load(file = "./TCGA-colrectum/colrectal_clin.rdata")- 1
maftools包添加临床信息的方式非常简单,只要两个文件都有Tumor_Sample_Barcode这一列且对得上就行。所以我们还要对snp文件和临床信息进行一些简单的处理。- 对于两个文件中的
Tumor_Sample_Barcode这一列,我们只要前12个字符即可 - 临床信息中有一些是Normal的样本,需要去除
- 之选择在snp文件中有的样本
# 只要前12个字符 colrec_snp$Tumor_Sample_Barcode <- substr(colrec_snp$Tumor_Sample_Barcode,1,12) head(colrec_snp$Tumor_Sample_Barcode) ## [1] "TCGA-D5-6530" "TCGA-D5-6530" "TCGA-D5-6530" "TCGA-D5-6530" "TCGA-D5-6530" ## [6] "TCGA-D5-6530"- 1
- 2
- 3
- 4
- 5
如果你是像我这样直接用的
TCGAbiolinks包下载的数据,那这个临床信息直接包含了sample_type这一列,不需要自己根据样本名确定到底是normal还是tumor,十分方便。index <- unique(colrec_snp$Tumor_Sample_Barcode) # 只要肿瘤样本 clin_snp <- clin[!clin$sample_type == "Solid Tissue Normal", ] # 只要snp文件中有的样本 clin_snp <- clin_snp[clin_snp$patient %in% index, ] # clin中没有Tumor_Sample_Barcode这一列,直接添加一列 clin_snp$Tumor_Sample_Barcode <- clin_snp$patient- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
这样两个需要的文件就制作好了。
colrec_snp[1:5,1:5] ## X1 Hugo_Symbol Entrez_Gene_Id Center NCBI_Build ## 1 1 AGRN 375790 BCM GRCh38 ## 2 1 ACAP3 116983 BCM GRCh38 ## 3 1 CALML6 163688 BCM GRCh38 ## 4 1 PRKCZ 5590 BCM GRCh38 ## 5 1 WRAP73 49856 BCM GRCh38- 1
- 2
- 3
- 4
- 5
- 6
- 7
clin_snp[1:5,1:5] ## barcode patient ## TCGA-A6-5664-01A-21R-1839-07 TCGA-A6-5664-01A-21R-1839-07 TCGA-A6-5664 ## TCGA-D5-6530-01A-11R-1723-07 TCGA-D5-6530-01A-11R-1723-07 TCGA-D5-6530 ## TCGA-AA-3556-01A-01R-0821-07 TCGA-AA-3556-01A-01R-0821-07 TCGA-AA-3556 ## TCGA-AA-3818-01A-01R-0905-07 TCGA-AA-3818-01A-01R-0905-07 TCGA-AA-3818 ## TCGA-AA-3660-01A-01R-1723-07 TCGA-AA-3660-01A-01R-1723-07 TCGA-AA-3660 ## sample shortLetterCode ## TCGA-A6-5664-01A-21R-1839-07 TCGA-A6-5664-01A TP ## TCGA-D5-6530-01A-11R-1723-07 TCGA-D5-6530-01A TP ## TCGA-AA-3556-01A-01R-0821-07 TCGA-AA-3556-01A TP ## TCGA-AA-3818-01A-01R-0905-07 TCGA-AA-3818-01A TP ## TCGA-AA-3660-01A-01R-1723-07 TCGA-AA-3660-01A TP ## definition ## TCGA-A6-5664-01A-21R-1839-07 Primary solid Tumor ## TCGA-D5-6530-01A-11R-1723-07 Primary solid Tumor ## TCGA-AA-3556-01A-01R-0821-07 Primary solid Tumor ## TCGA-AA-3818-01A-01R-0905-07 Primary solid Tumor ## TCGA-AA-3660-01A-01R-1723-07 Primary solid Tumor- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
读取数据
两个文件都没有问题,直接读取即可。
colrec.maf <- read.maf(colrec_snp,clinicalData = clin_snp) ## -Validating ## --Removed 41322 duplicated variants ## -Silent variants: 67679 ## -Summarizing ## --Mutiple centers found ## BCM;WUGSC;BCM;WUGSC;BCM;BI--Possible FLAGS among top ten genes: ## TTN ## SYNE1 ## MUC16 ## -Processing clinical data ## --Annotation missing for below samples in MAF: ## TCGA-AA-3695 ## TCGA-AA-3967 ## TCGA-AF-2689 ## TCGA-AF-3914 ## TCGA-AG-3891 ## TCGA-AG-3906 ## TCGA-AZ-4681 ## -Finished in 7.170s elapsed (6.480s cpu)- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
画图也是没有问题的,关于这个包的使用网络上教程非常多,也很全面,大家直接百度即可,这里就简单演示下。
plotmafSummary(colrec.maf)- 1
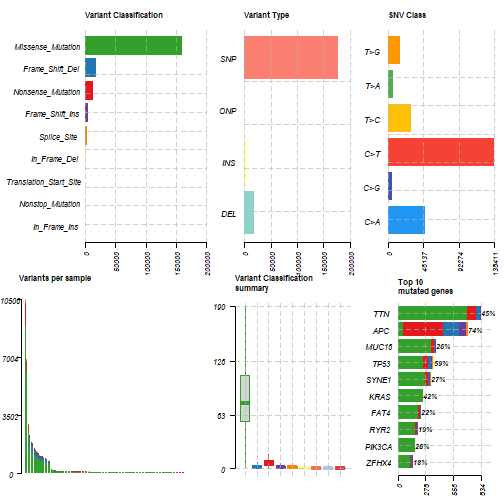
最常见的额瀑布图:
oncoplot(maf = colrec.maf, clinicalFeatures = c("ajcc_pathologic_stage","vital_status"), top = 30, sortByAnnotation=T )- 1
- 2
- 3
- 4
- 5
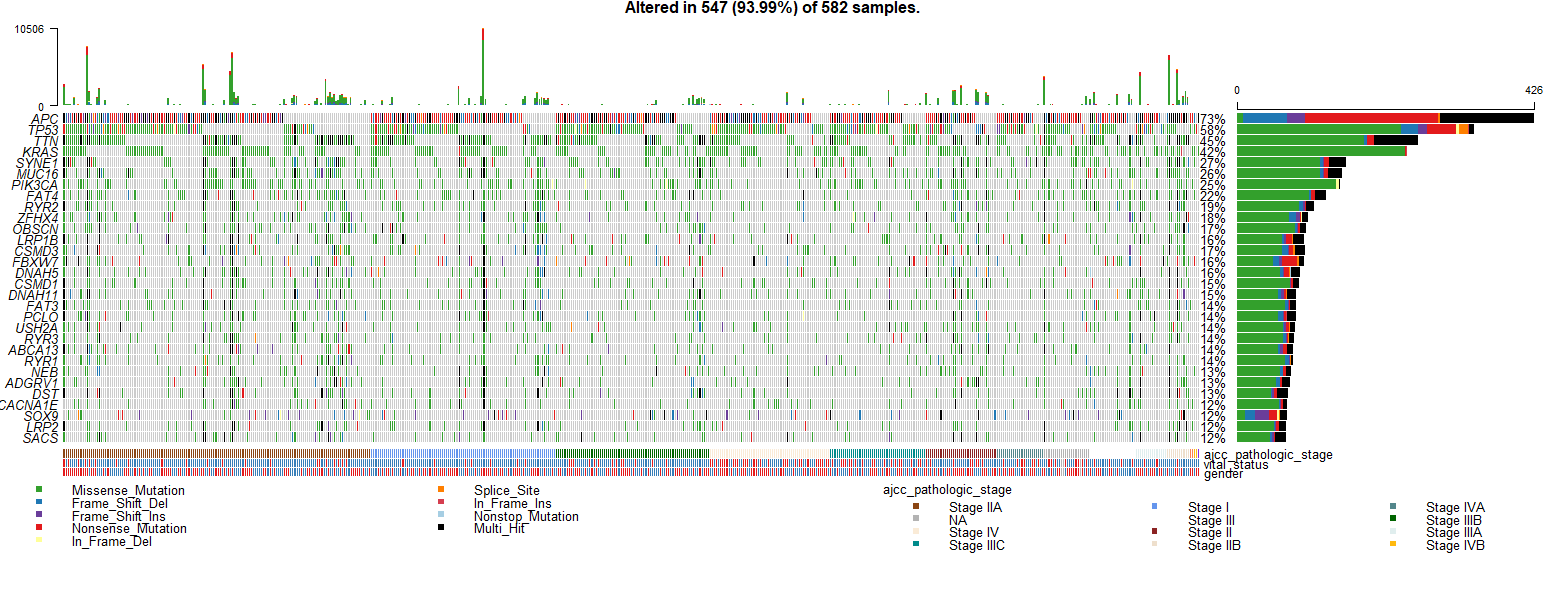
这个图其实就是
Complexheatmap画出来的,之前的推文里详细介绍了这个R包,感兴趣的可以看一看:xxxxxxxxxxx
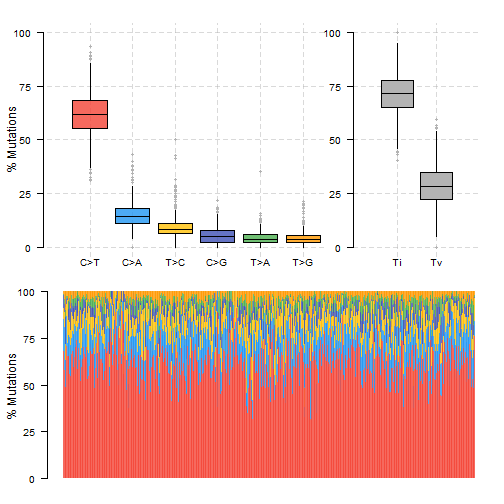
xxxxxxxxxxxxxxxxxxxx
xxxxxxxxxxcolrec.titv = titv(maf = colrec.maf, plot = FALSE, useSyn = TRUE) #plot titv summary plotTiTv(res = colrec.titv)- 1
- 2
- 3
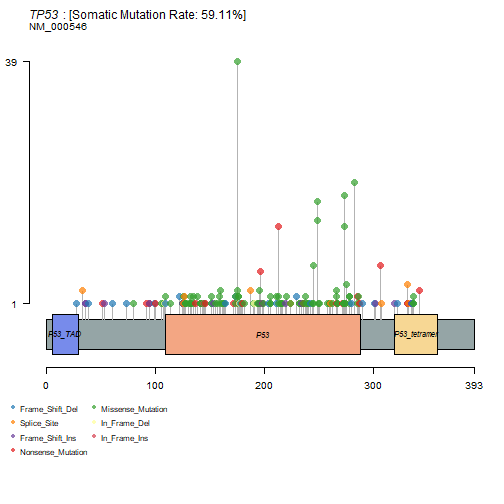
比较有意思的棒棒糖图,这个图可以用
trackviewer包画的更好看,下次介绍。画出来简单,但是解释过程挺复杂的,涉及到下游氨基酸的变化,需要了解碱基变化命名规则和氨基酸变化命名规则才能知道具体意思。
lollipopPlot(colrec.maf, gene = "TP53", AACol = "HGVSp_Short" # 需要注意这一列 ) ## 8 transcripts available. Use arguments refSeqID or proteinID to manually specify tx name. ## HGNC refseq.ID protein.ID aa.length ## 1: TP53 NM_000546 NP_000537 393 ## 2: TP53 NM_001126112 NP_001119584 393 ## 3: TP53 NM_001126118 NP_001119590 354 ## 4: TP53 NM_001126115 NP_001119587 261 ## 5: TP53 NM_001126113 NP_001119585 346 ## 6: TP53 NM_001126117 NP_001119589 214 ## 7: TP53 NM_001126114 NP_001119586 341 ## 8: TP53 NM_001126116 NP_001119588 209 ## Using longer transcript NM_000546 for now.- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
拷贝数变异肯定也是没有问题的,也是用的之前合并后的数据,然后经过gistic处理,就得到了我们需要的文件,关于gistic这个软件的使用,大家百度即可~
all.lesions <- "./TCGA-colrectum/TCGA_COREAD_results/all_lesions.conf_90.txt" amp.genes <- "./TCGA-colrectum/TCGA_COREAD_results/amp_genes.conf_90.txt" del.genes <- "./TCGA-colrectum/TCGA_COREAD_results/del_genes.conf_90.txt" scores.gis <- "./TCGA-colrectum/TCGA_COREAD_results/scores.gistic" colrec.gistic = readGistic(gisticAllLesionsFile = all.lesions, gisticAmpGenesFile = amp.genes, gisticDelGenesFile = del.genes, gisticScoresFile = scores.gis, isTCGA = TRUE) ## -Processing Gistic files.. ## --Processing amp_genes.conf_90.txt ## --Processing del_genes.conf_90.txt ## --Processing scores.gistic ## --Summarizing by samples colrec.gistic ## An object of class GISTIC ## ID summary ## 1: Samples 611 ## 2: nGenes 2791 ## 3: cytoBands 88 ## 4: Amp 97455 ## 5: Del 313297 ## 6: total 410752- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- 13
- 14
- 15
- 16
- 17
- 18
- 19
- 20
- 21
- 22
- 23
- 24
- 25
结果也是毫无问题!
准备自己的数据,就是如此的简单。
-
相关阅读:
Unet医学细胞分割实战
【若依框架RuoYi-Vue-Plus 图片回显不显示问题,OSS文件上传或者本地上传】
NewStarCTF2023week4-RSA Variation II
软考高级系统架构师_计算机组成与结构02_高速缓存_磁盘结构_输入输出技术_总线结构_可靠性_---软考高级系统架构师005
.trim() 方法 的含义及使用场景
MCE 产品发表高分文章锦集
2-6 jdbc查询数据库返回 json结果到浏览器
Git迁移新仓库并保存历史提交记录
【Java】HashMap、HashTable和ConcurrentHashMap的区别
java设计模式之工厂方法模式
- 原文地址:https://blog.csdn.net/Ayue0616/article/details/127824244
