-
Cell | 膳食糖诱导的微生物失调破坏免疫介导的代谢综合征保护
膳食糖诱导的微生物失调破坏免疫介导的代谢综合征保护
Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome

Research Article,2022-8-29,Cell, [IF 66.85]
DOI:https://doi.org/10.1016/j.cell.2022.08.005
第一作者:Yoshinaga Kawano
通讯作者:Ivaylo I. Ivanov
- 摘要 -
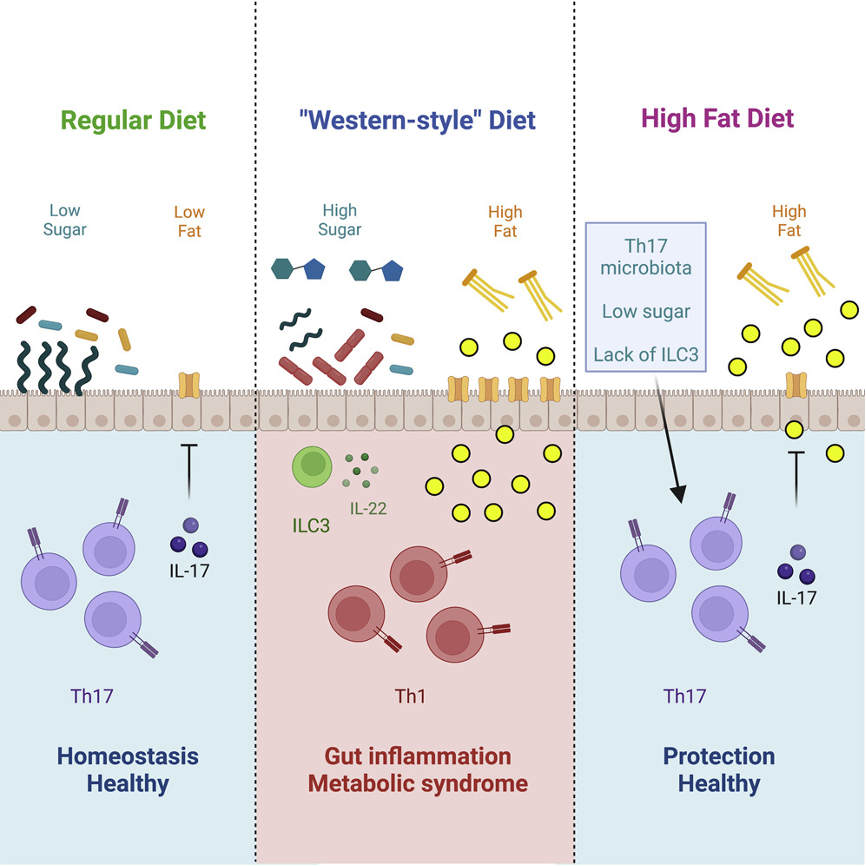
目前肠道微生物如何调节代谢综合征尚未研究透彻。作者发现,肠道微生物通过诱导共生特异性Th17细胞来预防肥胖、代谢综合征和糖尿病前期表型的发生。高脂和高糖饮食通过消耗诱导Th17的微生物促进代谢疾病,而恢复共生Th17细胞能够恢复保护作用。微生物诱导的Th17细胞通过IL-17依赖的方式调节脂质在肠上皮细胞的吸收,从而起到保护作用。饮食诱导的保护性Th17细胞的丧失由糖介导,从高脂饮食中清除糖能够缓解小鼠的肥胖和代谢综合征,其方式依赖于共生特异性Th17细胞。糖和ILC3促进了Faecalibaculum rodentium的扩增,取代了能够诱导Th17的微生物。这些结果阐明了具有导致代谢综合征风险的饮食和微生物因素。他们还揭示了膳食糖的免疫致病性的微生物依赖机制,并强调了饮食、微生物和肠道免疫在调节代谢紊乱方面的复杂相互作用。
- 背景 -
肥胖和代谢综合征是一种复杂的生理状况,可导致许多疾病,包括心血管疾病、中风和2型糖尿病。饮食是增加肥胖和代谢综合征发病率的一个主要因素。在人和小鼠中,西式高脂肪饮食(HFD)导致了这一系列事件的发生,最终引发肥胖和肥胖相关的代谢并发症,如代谢综合征和2型糖尿病。虽然我们对这些疾病的后期病理生理学了解颇多,但引发的原因尚不完全清楚。此外,还没有很好地确定非脂肪膳食成分的作用。例如,饮食中的糖含量是否为代谢综合征的一个重要因素,糖驱动代谢紊乱的机制尚不清楚。肠道是最大的免疫器官,也是饮食抗原与宿主接触的地点。肠道免疫系统已成为代谢稳态的重要调节因子。HFD与肠道炎症增加有关,可导致内毒素血症和脂肪组织炎症。高脂饮食增加肠道炎症的机制以及介导这些变化的饮食成分尚未明确。此外,粘膜免疫细胞如何影响饮食诱导的肥胖和代谢综合征尚不清楚。
CD4+T细胞在维持组织内稳态和指引肠道和其他组织的免疫反应中发挥着核心作用。然而,单个辅助性T细胞亚群对代谢综合征的贡献尚不清楚。Th17细胞可促进代谢综合征相关的炎症表型,以及防止肥胖和代谢综合征。同样,ILC3和ILC3来源的IL-22在代谢综合征中发挥保护和促进作用。因此,免疫细胞的作用似乎很复杂,可能与环境有关。然而,控制这种功能异质性的环境或其他信号的性质尚不清楚。
微生物是肠道免疫的重要调节因子,包括T细胞和ILC3应答。HFD诱导微生物组成的变化在肥胖表型中起着至关重要的作用。HFD微生物群可以通过增加能量获取来促进代谢综合征,包括卡路里摄取和肠道脂质吸收,或通过诱导肠上皮屏障破坏和内毒素血症,导致脂肪组织炎症。HFD相关的微生物群也会通过调节免疫反应来影响代谢综合征。在代谢综合征中调节宿主免疫的饮食和微生物群,以及相关的细胞和分子机制尚不清楚。
在这里,作者研究了微生物群控制的肠道免疫,特别是3型免疫在早期诱导DIO和代谢综合征中的作用。作者发现微生物群诱导的Th17细胞对DIO和代谢综合征具有保护作用。作者确定了涉及的饮食和微生物群成分,这些成分如何控制诱导Th17细胞的微生物群,以及它们以依赖性方式控制代谢综合征的机制。作者还通过抑制免疫保护性微生物群,对糖在代谢疾病中的致病作用提出了另一种解释。
- 结果 -
HFD通过破坏诱导Th17的微生物群破坏肠道免疫稳态
为了确定代谢综合征的起因,作者在脂肪组织发生炎症之前的4周检测了HFD对肠道免疫稳态的影响。在小肠固有层(SI LP)中,HFD导致RORγt+Foxp3negTh17细胞的比例和总数显著下降(图1A和1B),但对RORγtneg或RORγt+Foxp3+Tregs细胞没有影响(图1D),这表明Th17细胞的功能性丧失。细胞因子染色结果显示,在HDF喂养的小鼠中,IL-17+Th17细胞的百分比和总数降低(图1E和1F),回肠末端il17转录水平的降低(图1G)。同时,HDF喂养还导致了SI LP Th1细胞比例增加。因此,HFD导致肠道Th17细胞免疫下降。SI LP Th17细胞的损失发生在向HFD过渡的第7天(图1I),并促进固有层Th1细胞的增加。作者之前的研究表明,在SPF小鼠中,共生微生物,特别是节段丝状菌(SFB)诱导了SI LP Th17细胞。因此,作者研究了HFD是否影响SFB水平。向HFD过渡导致SFB从粪便和回肠黏膜迅速流失(图1J和1K)。值得注意的是,SFB的丢失先于Th17细胞的丢失(图1I和1J)。因此,SI LP Th17细胞在向HFD转变后的减少发生在SFB的损失后。为了证实HFD诱导的SFB损失破坏了SFB特异性Th17细胞的诱导,作者将同源SFB特异性7B8 TCR Tg T细胞转移到NCD或HFD的SFB阳性小鼠中(图1L)。7B8 CD4 T细胞在NCD对照组中扩增分化为Th17细胞(图1M-O)。相比之下,SFB特异性CD4 T细胞在HFD喂养的小鼠中没有扩增或生成Th17细胞(图1M-O)。这些结果表明SFB和SFB的T细胞抗原在过渡到HFD后都丢失了。综上所述,HFD能够使诱导Th17细胞的微生物快速丧失,从而导致稳态平衡和Th17细胞在代谢综合征发生前的缺失。

图1 HFD通过破坏诱导Th17的微生物群破坏肠道免疫稳态
微生物诱导的Th17细胞保护代谢综合征
Th17细胞和ILC3都参与了对代谢综合征的保护并被SFB调控。因此,作者研究了Th17细胞和ILC3在代谢综合征中的作用的差异。作者建立了一个小鼠模型,在该模型中ILC3的发育被选择性地损伤,同时保留了T细胞池。RORγ-STOP-flox(STOP)小鼠同时缺失ILC3与Th17细胞,STOP/CD4-Cre(STOP/CD4)小鼠具有Th17分化功能但缺失ILC3。SFB阴性STOP、STOP/CD4和WT同窝小鼠定植SFB并HFD喂养。在过渡到HFD后,WT小鼠仍然迅速丢失SFB。相比之下,在ILC3缺失小鼠中,HFD并没有导致SFB的丢失(STOP或STOP/CD4) (图2A及2B)。这表明ILC3是HFD介导的SFB丢失所必需的。不考虑SFB的情况下,HFD喂养的STOP小鼠不产生Th17细胞(图2C及2D)。相比之下,SFB定植的STOP/CD4小鼠即使在HFD喂养下也能保持高水平的SI LP Th17细胞(图2C)。正如预期的那样,SFB阴性的STOP/CD4小鼠缺乏SI LP Th17细胞(图2D)。接下来,作者比较了ILC3/Th17缺陷的STOP小鼠和ILC3缺陷/Th17充足的STOP/CD4小鼠DIO和代谢综合征的发生情况。在SFB缺失诱导的Th17细胞缺失的情况下(图2D),两种ILC3缺陷小鼠均表现出体重增加(图2E)和代谢综合征表型,例如胰岛素抵抗和葡萄糖耐受增加(图2F及2G)。此外,ILC3缺失的STOP和SFB阴性的STOP/CD4小鼠的体重增加和代谢综合征表型略有增加,但与WT对照组相比显著增加(图2E-2J)。在SFB Th17细胞存在的情况下(图2C),STOP/CD4小鼠类似于NCD喂养的WT对照组,并没有DIO,包括体重增加(图2H),以及与代谢综合征相关的糖尿病前期表型(图2I和2J)。除了维持SI LP Th17细胞外(图2C),他们的肝脏病理还降低,包括减少细菌易位和Tnfa转录(图2K和2L)。因此,STOP/CD4小鼠对DIO和代谢综合征的保护与SFB诱导的Th17细胞的存在相关。
为了证实CD4 T细胞介导的保护作用,作者使用CD4抗体清除了SFB/Th17阳性STOP/CD4小鼠的CD4 T细胞,并给予HFD。在清除CD4 T细胞的STOP/CD4小鼠中,对DIO和代谢综合征的抵抗消失了(图2M及2N)。作者还将STOP/CD4小鼠与TCRβ-KO小鼠杂交,从基因上删除αβ T细胞。TCRβKO-STOP/CD4小鼠对DIO和代谢综合征易感(图2O及2P)。总之,这些实验证明共生的Th17细胞对于微生物介导的DIO和代谢综合征的保护是必需的。
为了研究Th17细胞是否足以给予保护,作者将WT CD4 T细胞转移到SFB定植的代谢综合征易感STOP小鼠中。与未接受处理的小鼠相比,采用CD4 T细胞移植的STOP小鼠明显免受DIO和代谢综合征的影响(图2Q和2R)。上述研究表明肠道微生物可通过诱导肠道Th17细胞介导对代谢综合征的保护。微生物诱导的Th17细胞对于提供保护、预防或抑制肥胖和糖尿病前期表型的发展是必要和充分的。
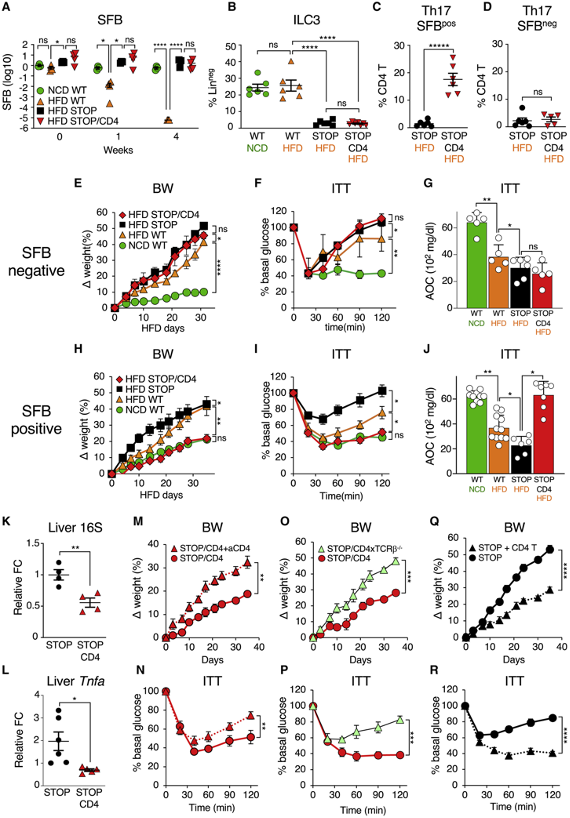
图2 微生物诱导的Th17细胞预防代谢综合征
诱导Th17细胞的益生菌改善代谢综合征
前面的结果表明,HFD的致病原因之一是通过消耗诱导Th17细胞的微生物,以清除稳态共生的肠道Th17细胞。作者推测,在HFD条件下,通过恢复诱导Th17细胞的微生物来恢复肠道Th17细胞,可以改善DIO和代谢疾病。因此,作者连续4周每隔1天向SFB阳性的HFD喂养的WT小鼠灌胃SFB或对照细菌(图3A)。灌胃对照细菌的HFD小鼠失去SFB(图3B),由于SI LP Th17细胞减少(图3D和3E),导致肠道Il17a转录减少(图3C)。这些小鼠还出现了肥胖和代谢性疾病(图3G-3L)。SFB处理可部分但显著地恢复粪便内容物中的SFB水平(图3B)。重要的是,SFB处理的小鼠SI LP Th17细胞(图3D和3E)和回肠末端IL-17的表达(图3C)显著恢复。与对照组相比,SFB处理的小鼠在HFD喂养下体重增加显著减少(图3G和3H),糖尿病前期表型缓解,包括胰岛素抵抗(图3I和3J)和葡萄糖耐受(图3K和3L)。SFB处理的小鼠也显示出HFD诱导的肠道炎症的改善,包括炎症Th1细胞的减少(图3F)。综上所述,诱导Th17细胞益生菌疗法可以通过恢复肠道T细胞稳态显著改善DIO和代谢综合征。

图3 诱导Th17细胞的益生菌改善代谢综合征
膳食糖通过消除共生Th17细胞促进代谢综合征
接下来,作者研究了导致保护性共生Th17细胞缺失的原因。高脂饮食的两个主要特征是过量的脂肪含量和低膳食纤维。然而,作者通过使用对照低脂日粮(LFD)来去除HFD配方中的多余脂肪,或以菊粉的形式添加膳食纤维并没有恢复SFB(图4A)。作者提出了一个问题,与NCD相比,SFB的缺失是由于HFD中存在抑制SFB的营养成分还是缺乏某种营养成分?为了回答这个问题,作者同时给小鼠提供两种饮食。作者推断,如果HFD含有过量的抑制成分,那么即使在NCD存在的情况下,它仍应抑制SFB。或者,缺失的营养成分将通过补充NCD得到恢复。用SFB定植WT小鼠,然后喂食NCD、HFD或50:50混合饲料(图4B)。以50:50的比例添加NCD和HFD营养成分并不能阻止SFB的减少(图4B)。这提示HFD含有一种抑制成分,因此作者关注到了HFD配方中富集的营养成分。除了脂肪,HFD中另一种高代表性成分是膳食糖。NCD配方含3%-6%的糖,而HFD配方含25%的膳食糖,包括10%的蔗糖和15%的麦芽糖糊精。蔗糖和麦芽糖糊精(包装食品中常见的成分,包括糖果和软饮料)被认为会增加代谢综合征的风险。将蔗糖加入NCD喂养的野生型小鼠的饮用水中,以剂量依赖性的方式消除SFB(图4C)。10%蔗糖或麦芽糊精可降低NCD饲养小鼠粪便和回肠黏膜中的SFB水平(图4C)。接下来,作者检测了蔗糖对肠道Th17细胞的影响。与HFD类似,在NCD喂养的小鼠的水中添加蔗糖可以降低SI LP中的RORγt+和IL-17+Th17细胞(图4D和4E)。与HFD一致,蔗糖喂养的小鼠中剩余的Th17细胞的RORγt水平下降,表明功能受到干扰(图4F和4G)。
为了研究膳食糖对Th17细胞的保护作用,作者用淀粉代替膳食中的蔗糖和麦芽糖糊精,产生无糖HFD(SF-HFD)。SF-HFD诱导的肥胖和代谢综合征与SFB阴性小鼠的对照HFD相似(图4H和4K)。相比之下,SFB定植的SF-HFD喂养的小鼠免受体重增加(图4L)、胰岛素抵抗(图4M和4N)的影响。与HFD喂养的小鼠相比,灌胃SFB的SF-HFD小鼠保持了高水平的保护性Th17细胞(图4O)。为了证实SF-HFD的积极作用是由于不含糖,并为了控制其他潜在的饮食影响,作者进行了一组单独的实验,在一些SF-HFD小鼠的饮用水中加入10%的蔗糖。与之前一样,SFB定植的SF-HFD小鼠维持肠道Th17细胞,并免受DIO和代谢综合征的影响(图4P和4Q)。然而,当在饮用水中添加糖时,SF-HFD喂养的小鼠所获得的保护作用就完全消失了。这些小鼠失去了肠道Th17细胞,与HFD喂养的小鼠一样容易患肥胖和代谢综合征(图4P和4Q)。为了证实SF-HFD的保护作用是由Th17细胞介导的,作者检测了特异性缺乏Th17细胞分化的RORγt-flox/CD4-Cre小鼠。用SFB定植RORγt-flox/CD4-Cre和同窝对照,喂食SF-HFD。与对照组WT同窝小鼠相比,这些小鼠失去了对DIO和代谢综合征的保护(图4R和4S)。与WT同窝小鼠相比,SF-HFD组Th17细胞缺陷小鼠体重增加(图4R)、胰岛素抵抗(图4S)。综上所述,在DIO和代谢综合征的情况下,饮食中的糖通过消耗肠道共生Th17细胞,抵消了这些细胞的保护作用。此外,消除饮食中的糖不足以提供治疗效果;保护作用也需要共生Th17细胞的存在。因此,饮食干预可能需要与免疫疗法相结合,以达到预期的效果。

图4 膳食糖通过消除共生Th17细胞促进代谢综合征
膳食糖通过增加丹毒菌科(Erysipelotrichiaceae)取代Th17微生物
接下来,作者研究了膳食糖取代SFB和保护代谢综合征Th17细胞的机制。为了考虑宿主效应,作者在饮用水中加入10%的蔗糖处理SFB单定植WT小鼠。与SPF小鼠相比(图4C),膳食糖不影响单定植小鼠的SFB水平(图5A)。因此,膳食糖取代SFB需要共生微生物的存在。为了确定介导糖作用的共生微生物,作者比较了在饮用水中饲喂NCD、HFD或NCD+10%蔗糖的小鼠的微生物群组成(图5B-5F)。HFD喂养的小鼠和糖处理的小鼠与NCD喂养的小鼠由不同的微生物组成,并且两个组之间也存在显著差异(图5B)。这使作者能够缩小消耗Th17(HFD和糖)和支持Th17(NCD)饮食之间的微生物区系差异。在家族水平上,在两种Th17耗尽饲粮中,Erysipelotrichaceae、Ruminococcaceae和Lachnospiraceae均表达上调(图5C)。与NCD相比,Erysipelotrichaceae是在HFD和10%糖中含量最高、最显著富集的家族(图5C)。Erysipelotrichaceae的扩张已经在代谢紊乱中有过报道,包括小鼠的DIO,以及人类的肥胖。在作者的数据中,Erysipelotrichaceae扩增包含几个OTU。然而,一种特殊的OTU,被确定为Faecalibaculum rodentium(Frod),在HFD和10%糖处理小鼠中均有过量表达(图5D-5F)。作者通过qPCR证实了Frod在HFD和糖处理小鼠中的扩增(图5G)。对小鼠体内SFB和Frod水平的比较发现,两种微生物成员之间存在很强的负相关关系(图5H)。为了研究这是否是由于Frod无法在ILC3缺陷小鼠体内定植或扩张的原因,作者比较了膳食干预后的定植动力学。为此,作者首先用氨苄西林(Amp)预处理WT和ILC3缺陷的STOP/CD4小鼠,消除内源性Frod。接下来,作者通过灌胃引入外源性Frod,并跟踪定殖动力学。为了检测Frod,在饮用水中也添加了10%的蔗糖(图5I)。Frod灌胃后不久(第2天),WT和STOP/CD4小鼠的粪便中Frod水平增加(图5J和5K),这表明Frod能够在缺乏ILC3的小鼠中定植。饮用水中的糖导致WT小鼠第10天的Frod显著增加(图5J)。相比之下,糖处理的STOP/CD4小鼠在第10天几乎检测不到Frod(图5K)。上述结果表明,糖介导的Frod扩增需要ILC3。

图5 膳食糖通过增加丹毒菌科(Erysipelotrichiaceae)取代Th17微生物
以上结果表明,糖或HFD介导的Frod扩增是SFB损失的原因。因此,作者使用无菌小鼠来直接测试Frod是否足以胜过或取代SFB。作者首先尝试通过同时灌胃SFB和Frod两种细菌来定植无菌(GF)小鼠(图6A)。当单独提供SFB时,GF小鼠的定植水平很高(图6B)。相比之下,当SFB和Frod一起灌胃时,SFB的水平要低100倍(图6B和6C)。在SFB/Frod双定植小鼠的饮用水中添加糖会导致Frod扩增,甚至进一步降低SFB水平(图6D-6F)。作者还提出Frod是否可以取代已经存在的SFB。GF小鼠先用SFB定植,然后用Frod或对照菌定植(图6G)。在定植Frod之前,所有小鼠均采用类似的SFB定植(图6H)。定植Frod后SFB很快消失(图6H和6I)。Frod灌胃24 h后,SFB和Frod在无菌小鼠中同时存在,并在末端回肠黏液中占据相同的生态位,靠近上皮细胞,且相互接近(图6J和6K)。这些结果表明,膳食糖以ILC3依赖的方式使Erysipelotrichaceae的成员(尤其是Frod)扩增,从而取代SFB并减少保护性肠道Th17细胞。

图6 Faecalibaculum rodentium能够取代SFB
共生Th17细胞通过调节肠道脂质吸收来预防代谢综合征
接下来,作者研究了共生Th17细胞对代谢综合征提供保护的机制。IL-17对肠上皮细胞(IECs)有很强的作用,并保持屏障的完整性。肠道中,脂质的上皮吸收是代谢综合征的已知调节因子。因此,作者研究了共生Th17细胞对肠道脂质吸收的影响。作者比较了HFD喂养的Th17缺陷的STOP小鼠(发生代谢综合征)和Th17充足的STOP/CD4小鼠(Th17细胞保护免受代谢综合征)不同组织中的脂质浓度。STOP/CD4小鼠IECs和肝脏中脂质含量显著降低(图7A和7B),但粪便中脂质含量升高(图7C)。这表明Th17细胞的存在降低了IEC的脂质吸收,并伴随脂质在肠腔内的积累。事实上,在STOP/CD4小鼠的IEC中,参与脂质摄取和运输的几个基因表达下调(图7D),最显著的是CD36,编码膳食脂肪酸进入细胞的转运器(图7D)。STOP/CD4 IEC中CD36的下调需要T细胞,但在HFD喂养的αβ T细胞缺陷的STOP/CD4小鼠的IEC中没有观察到(图7E)。
上皮细胞CD36对膳食脂肪吸收具有强大的作用,从而调节代谢综合征。CD36在脂肪分解发生的十二指肠和脂肪吸收最多的空肠高表达,在稳态下,其在回肠中的表达较低。作者发现SFB定植特异性下调了远端SI(空肠和回肠)中CD36基因的表达,但不下调十二指肠的表达(图7F-7H)。CD36下调依赖于Th17细胞来源的IL-17,因为在Th17缺陷的RORγt-flox/CD4-Cre小鼠(图7F-7H)、IL-17A缺陷小鼠(图7I)或用IL-17A抗体处理的WT小鼠中(图7J)CD36的表达量降低。因此,共生的Th17细胞可以通过CD36降低脂质摄取,并以IL-17依赖的方式降低远端SI的脂质吸收。为了研究IL-17是否直接作用于IEC,作者从独立发表的数据集中研究了IL-17对SI肠样中CD36表达的影响。一个RNA测序(RNA-seq)数据的分析显示,IL-17处理的体外回肠末端肠样中CD36表达显著降低(图7K)。综上所述,这些数据提示Th17细胞来源的IL-17可以直接抑制SI肠上皮细胞中CD36的表达。
作者假设糖敏感的共生体Th17细胞可以通过抑制CD36的上调来起到保护作用。的确,在缺乏SFB特异性Th17细胞的情况下,HFD和SF-HFD诱导回肠和空肠IEC中CD36的上调相似(图7L)。然而,在SF-HFD喂养的小鼠中,这种上调在共生Th17细胞存在时被显著抑制(图7L)。
为了直接解决Th17细胞的保护作用是否需要CD36,作者给SFB阴性和SFB定植的WT和CD36缺失的小鼠SF-HFD。如前所述,SFB诱导的Th17细胞在WT小鼠中对SF-HFD诱导的代谢综合征提供保护(图7M-7Q)。正如先前报道的那样,与野生型小鼠相比,CD36缺陷小鼠发生代谢综合征的数量显著减少(图7M-7Q)。然而,与野生型小鼠相比,SFB的Th17细胞在缺乏CD36的情况下不能提供额外的保护(图7M-7Q)。上述结果表明,共生的Th17细胞来源的IL-17通过控制脂肪酸转运体CD36的上皮表达,在DIO过程中特异性降低远端SI的脂质摄取和吸收。

图7 共生Th17细胞通过调节肠道脂质吸收来预防代谢综合征
参考文献
Yoshinaga Kawano, et al., Yoshinaga KawanoMicrobiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome. Cell. 2022
- 作者简介 -
通讯作者

哥伦比亚大学
Ivaylo Ivanov
副教授
Ivaylo Ivanov博士在保加利亚的索菲亚大学获得生物技术学士学位和分子生物学硕士学位。之后在阿拉巴马大学伯明翰分校的细胞和分子生物学获得博士学位。随后,他加入了纽约大学斯柯波尔研究所Dan Littman博士的实验室,担任黏膜免疫学博士后。2011年,他加入哥伦比亚大学微生物和免疫学系。
Ivaylo Ivanov实验室的主要研究方向之一是探究SFB发挥其免疫调节作用的机制,特别关注与SFB粘附到肠上皮细胞和Th17细胞诱导有关的分子机制,以及参与这一过程的细菌基因。另一个研究方向是鉴定固有层中的免疫细胞亚群,如肠道树突状细胞、先天淋巴细胞和肠上皮细胞,它们如何参与共生细菌的信号传递,并为Th17和Treg分化产生独特的细胞因子环境,以及诱导免疫反应在对抗肠道感染中的作用。
猜你喜欢
iMeta简介 高引文章 高颜值绘图imageGP 网络分析iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读
-
相关阅读:
Linux篇19多线程第三部分
java基于springboot的社区物业维修报修平台—计算机毕业设计
堃博医疗创上市以来新低:年内跌幅超八成,市值累计蒸发90亿港元
《Effective C++》阅读总结(二):类的构造、析构和赋值
dvwa-暴力破解(low-high)
[附源码]计算机毕业设计JAVAjsp昭通推广网站开发
秋日渲染季 | 效果图充值新升级!金秋好礼等你领
Jenkins安装及项目配置
egg pkg编译 --no-deprecation问题
从搭建SpringMVC环境到实现增删改查&&文件上传-文件下载
- 原文地址:https://blog.csdn.net/woodcorpse/article/details/127626304